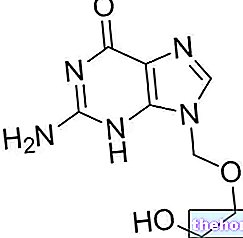
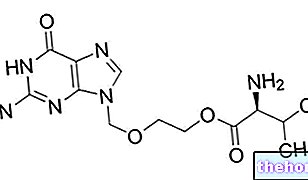
Účinné látky: flutikazón (flutikazónfuroát)
Avamys 27,5 mikrogramov na sprej, nosový sprej, suspenzia
Prečo sa používa Avamys? Načo to je?
Avamys (flutikazónfuroát) patrí do skupiny liekov nazývaných glukokortikoidy.
Avamys účinkuje tak, že znižuje zápal spôsobený alergiou (nádchou) a tým zmierňuje príznaky alergie. Nosový sprej Avamys sa používa na liečbu symptómov alergickej rinitídy vrátane upchatého, nádchy alebo svrbenia v nose, kýchania, slzenia očí, svrbenia a začervenania. očí, u dospelých a detí od 6 rokov.
Príznaky alergie sa môžu vyskytnúť v presne definovaných obdobiach roka a môžu byť spôsobené alergiou na peľ tráv alebo stromov (senná nádcha), alebo sa môžu vyskytnúť počas celého roka a sú spôsobené alergiou na zvieratá., Roztoče domáceho prachu alebo plesne vymenujte niekoľko najbežnejších.
Kontraindikácie Keď sa Avamys nemá používať
Neužívajte Avamys:
- Ak ste alergický na flutikazónfuroát alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6).
Opatrenia pri používaní Čo potrebujete vedieť predtým, ako užijete Avamys
Ak máte akékoľvek problémy s pečeňou, povedzte to svojmu lekárovi alebo lekárnikovi.
Deti a dospievajúci
Nepoužívať u detí mladších ako 6 rokov.
Užívanie Avamysu:
- môže spôsobiť, že deti budú pomalšie rásť, ak sa budú užívať dlhodobo. Váš lekár bude pravidelne kontrolovať výšku vášho dieťaťa a uistí sa, že užíva najnižšiu možnú účinnú dávku.
- môže spôsobiť očné choroby, ako je glaukóm (zvýšený vnútroočný tlak) alebo katarakta (zakalenie očnej šošovky). Povedzte svojmu lekárovi, ak ste v minulosti mali tieto ochorenia alebo ak počas užívania Avamysu spozorujete akékoľvek zmeny vo vašom zraku.
Interakcie Ktoré lieky alebo potraviny môžu zmeniť účinok Avamysu
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi.
Je obzvlášť dôležité povedať svojmu lekárovi, ak užívate alebo ste v poslednom čase užívali niektorý z nasledujúcich liekov:
- steroidy v tabletách alebo steroidy na injekciu
- krémy na báze steroidov
- lieky na astmu
- ritonavir, používaný na liečbu HIV
- ketokonazol, používaný na liečbu plesňových infekcií
Váš lekár skontroluje, či máte užívať Avamys s týmito liekmi.
Avamys sa nemá používať súčasne s inými nosovými sprejmi obsahujúcimi steroidy.
Upozornenia Je dôležité vedieť, že:
Tehotenstvo a dojčenie
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete užívať tento liek.
Neužívajte Avamys, ak ste tehotná alebo ak plánujete otehotnieť, pokiaľ vám to nepovie váš lekár alebo lekárnik.
Neužívajte Avamys, ak dojčíte, pokiaľ vám to nepovie váš lekár alebo lekárnik.
Vedenie vozidla a obsluha strojov
Je nepravdepodobné, že by Avamys narušil vašu schopnosť viesť vozidlo alebo obsluhovať stroje.
Avamys obsahuje benzalkóniumchlorid
U niektorých pacientov môže benzalkóniumchlorid spôsobiť podráždenie nosa. Ak pocítite pri použití spreja nepríjemné pocity, povedzte to svojmu lekárovi alebo lekárnikovi.
Dávka, spôsob a čas podávania Ako používať Avamys: Dávkovanie
Vždy používajte tento liek presne tak, ako vám povedal váš lekár alebo lekárnik. Neprekračujte odporúčané dávky. Ak máte pochybnosti, poraďte sa so svojim lekárom alebo lekárnikom.
Kedy použiť Avamys
- Vezmite si to raz denne
- Užívajte každý deň v rovnakom čase
To vám umožní ovládať vaše príznaky počas dňa a noci.
Ako dlho trvá, kým Avamys začne fungovať
Niektorí ľudia pocítia plnú účinnosť Avamysu niekoľko dní po prvom použití.
Normálne je však účinný do 8-24 hodín od prvého nazálneho podania.
Koľko Avamysu použiť
Dospelí a deti vo veku 12 a viac rokov
- Zvyčajná počiatočná dávka sú 2 vstreknutia do každej nosovej dierky jedenkrát denne, každý deň.
- Akonáhle sú symptómy pod kontrolou, je možné znížiť dávku na 1 vstrek do každej nosovej dierky, raz denne, každý deň.
Deti vo veku od 6 do 11 rokov
- Zvyčajná počiatočná dávka je 1 vstrek do každej nosovej dierky jedenkrát denne.
- Ak sú príznaky obzvlášť závažné, váš lekár môže zvýšiť dávku na 2 vstreky do každej nosovej dierky jedenkrát denne, každý deň, kým príznaky nie sú pod kontrolou. Preto môže byť možné znížiť dávku na 1 vstrek do každej nosovej dierky, raz denne, každý deň.
Ako používať nosový sprej
Avamys prakticky nemá chuť ani vôňu. Nastrekuje sa do nosa ako jemná hmla. Dávajte pozor, aby vám nešpliechala do očí. Ak sa to stane, vypláchnite si oči vodou.
KROK ZA KROKOM NÁVOD NA POUŽITIE NASÁLNEHO SPREJA
Ako vyzerá nosový sprej
Nosový sprej je dodávaný vo fľaši z jantárového skla vloženej do plastového zariadenia - pozri obrázok a. Fľaša obsahuje 30, 60 alebo 120 obláčikov, v závislosti od predpísaného obalu.
Okno na bočnej strane plastového inhalátora umožňuje vidieť množstvo lieku, ktoré zostáva vo fľaši. Hladinu tekutiny môžete vidieť pre novú fľašu s 30 alebo 60 vstrekmi, ale nie pre novú fľašu so 120 vstrekmi, pretože pre v druhom prípade je hladina kvapaliny nad oknom.
Šesť vecí, ktoré potrebujete vedieť o používaní nosového spreja
- Avamys sa dodáva vo fľaši z jantárového skla. Ak potrebujete skontrolovať, koľko lieku zostáva vo fľaši, držte nosový sprej vo zvislej polohe proti svetlu. Týmto spôsobom budete môcť vidieť hladinu lieku cez okno.
- Pri prvom použití nosového spreja by ste ho mali prudko trepať asi 10 sekúnd s nasadeným viečkom. To je dôležité, pretože Avamys je hustá suspenzia, ktorá sa pri dobrom pretrepaní stáva tekutou - pozri obrázok b. Liek bude sprejovať iba vtedy, keď bude tekutý
- Uvoľňovacie tlačidlo musíte pevne stlačiť, aby sa hmla uvoľnila cez trysku
- Ak máte problém stlačiť uvoľňovacie tlačidlo palcom, môžete použiť obe ruky
- Keď liek nepoužívate, vždy držte viečko na nosovom spreji. Veko udržuje prach mimo, utesňuje tlakom a zabraňuje upchatiu výtoku. Keď je veko na mieste, uvoľňovacie tlačidlo nemožno omylom stlačiť.
- Na čistenie trysky nepoužívajte špendlík ani špicaté predmety. To by zablokovalo nosový sprej.
Príprava nosového spreja na použitie
Nosový sprej musí byť pripravený:
- pred jeho prvým použitím
- ak bolo veko ponechané na mieste 5 dní alebo sa intranazálne zariadenie nepoužívalo 30 alebo viac dní
Príprava nosového spreja zaisťuje podanie celej dávky lieku. Postupujte podľa nasledujúcich krokov:
- Nosový sprej silne pretrepávajte s viečkom na mieste asi 10 sekúnd
- Odstráňte kryt pevným stlačením bokov krytu palcom a ukazovákom
- Nosový sprej držte vzpriamene, potom ho nakloňte a namierte dýzu smerom od seba.
- Pevne stlačte tlačidlo úplne. Opakujte operáciu najmenej 6 -krát, kým sa vo vzduchu nepozoruje riedka hmla
Nosový sprej je teraz pripravený na použitie.
Použitie nosového spreja
- Nosový sprej silno pretrepte.
- 2 Odstráňte kryt.
- 3 Vyfukujte nos, aby ste si vyčistili nosné dierky, a potom trochu predkloňte hlavu.
- 4 Umiestnite trysku do jednej z nosných dierok. Tryska by mala byť umiestnená vo vnútri nosnej dierky smerom von z nosa, mimo centrálnej prepážky. To podporuje uvoľnenie lieku v pravej časti nosa.
- Pri vdýchnutí nosom pevne stlačte tlačidlo
- Vytiahnite trysku a vydýchnite ústami.
- Ak sú predpísané dávky 2 vstreky do každej nosovej dierky, zopakujte kroky 4 až 6.
- Opakujte kroky 4 až 7, aby ste si ošetrili druhú nosnú dierku.
- Nasaďte viečko späť na nosový sprej.
Čistenie nosového spreja
Po každom použití:
- Vyčistite výtok a vnútornú stranu veka čistým, suchým obrúskom
- Na čistenie nosového spreja nepoužívajte vodu.
- Na výtok nikdy nepoužívajte špendlík alebo špicatý predmet.
- 4 Po použití vždy vráťte viečko na sprej.
Ak sa zdá, že nosový sprej nefunguje:
- Skontrolujte, či nezostal nejaký liek. Pozrite sa na hladinu lieku cez okno. Ak je hladina lieku veľmi nízka, nemusí ostať dostatočné množstvo na to, aby nosový sprej fungoval.
- Skontrolujte, či nie je nosový sprej poškodený.
- Ak si myslíte, že tryska môže byť upchatá, nepoužívajte na jej čistenie špendlík ani ostré predmety.
- Skúste to znova uviesť do prevádzky podľa pokynov v časti „Príprava nosového spreja na použitie“.
Ak nosový sprej stále nefunguje alebo ak vytvára prúd tekutého roztoku, vráťte nosový sprej svojmu lekárnikovi na radu.
Predávkovanie Čo robiť, ak ste užili príliš veľa lieku Avamys
Ak užijete viac Avamysu, ako máte
Povedzte to svojmu lekárovi alebo lekárnikovi.
Ak zabudnete užiť Avamys
Ak vynecháte dávku, užite ju, keď si spomeniete.
Ak sa blíži užitie ďalšej dávky, počkajte dovtedy. Neužívajte dvojnásobnú dávku, aby ste nahradili vynechanú dávku.
Ak máte ďalšie otázky týkajúce sa použitia tohto lieku alebo ak máte nejaké problémy s nosovým sprejom, požiadajte o radu svojho lekára alebo lekárnika.
Vedľajšie účinky Aké sú vedľajšie účinky lieku Avamys
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Alergické reakcie: ihneď kontaktujte lekára
Alergické reakcie na Avamys sú zriedkavé a postihujú menej ako 1 z 1 000 ľudí. U malého počtu ľudí sa môžu alergické reakcie, ak sa neliečia, vyvinúť v závažnejší, dokonca život ohrozujúci problém. Príznaky zahŕňajú:
- sipot, kašeľ alebo ťažkosti s dýchaním
- pocit náhlej slabosti alebo závratu (čo môže viesť ku kolapsu alebo strate vedomia)
- opuch tváre
- vyrážka alebo začervenanie.
V mnohých prípadoch tieto príznaky budú signalizovať menej závažné vedľajšie účinky. Mali by ste si však uvedomiť, že môžu byť potenciálne závažné - teda ak spozorujete niektorý z týchto príznakov:
Navštívte lekára čo najskôr.
Veľmi časté vedľajšie účinky (môžu postihnúť viac ako 1 z 10 ľudí)
- Krvácanie z nosa (zvyčajne mierne), najmä ak užívate Avamys viac ako 6 týždňov za sebou.
Časté vedľajšie účinky (môžu postihnúť až 1 z 10 ľudí)
- Ulcerácia nosa - ktorá môže spôsobiť podráždenie alebo nepríjemné pocity v nose. Pri smrkaní môžete tiež vidieť pruhy krvi.
- Bolesť hlavy
Menej časté vedľajšie účinky (môžu postihnúť až 1 zo 100 ľudí)
- Bolesť, pálenie, podráždenie alebo suchosť v nose.
Neznáme vedľajšie účinky (frekvenciu nemožno odhadnúť z dostupných údajov)
- Spomalenie rastu u detí.
- Dočasné zmeny videnia pri dlhodobom používaní.
Nosové kortikosteroidy môžu zmeniť normálnu produkciu steroidných hormónov vo vašom tele, najmä ak používate vysoké dávky po dlhšiu dobu. U detí môže tento vedľajší účinok spôsobiť, že budú rásť pomalšie ako u ostatných.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v Prílohe V. Vedľajšie účinky môžete pomôcť poskytnúť viac informácií o bezpečnosti tohto lieku.
Expirácia a retencia
Tento liek uchovávajte mimo dohľadu a dosahu detí
Najlepšie je uchovávať Avamys nosový sprej vo zvislej polohe. Vždy majte veko.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuli. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci. Po prvom použití by mal byť nosový sprej Avamys použitý do dvoch mesiacov.
Neskladujte Avamys v chladničke alebo mrazničke.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Pomáha to chrániť životné prostredie.
Zloženie a lieková forma
Čo Avamys obsahuje
Účinnou zložkou je flutikazónfuroát. Každá dávka obsahuje 27,5 mikrogramov flutikazónfuroátu.
Ďalšie zložky sú bezvodá glukóza, dispergovateľná celulóza, polysorbát 80, benzalkóniumchlorid, dinátriumedetát, čistená voda (pozri časť 2).
Ako vyzerá Avamys a obsah balenia
Liek je nosový sprej vo forme bielej suspenzie obsiahnutej vo fľaši z jantárového skla, vybavenej dávkovacou pumpičkou. Fľaša je obsiahnutá v sivobielom plastovom inhalátore so svetlomodrým viečkom a bočným tlačidlom, ktoré aktivuje sprej.
Plastový inhalátor má okno na zobrazenie obsahu fľaše.
Avamys je dostupný v baleniach po 30, 60 a 120 vstrekov.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Zdrojový leták: AIFA (Talianska agentúra pre lieky). Obsah zverejnený v januári 2016. Súčasné informácie nemusia byť aktuálne.
Aby ste mali prístup k najaktuálnejšej verzii, odporúča sa navštíviť webovú stránku AIFA (Talianska agentúra pre lieky). Vylúčenie zodpovednosti a užitočné informácie.
01.0 NÁZOV LIEKU
AVAMYS
02.0 KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každé stlačenie poskytne 27,5 mcg flutikazónfuroátu.
Úplný zoznam pomocných látok, pozri časť 6.1.
03.0 LIEKOVÁ FORMA
Nosový sprej, suspenzia.
Suspenzia bielej farby.
04.0 KLINICKÉ INFORMÁCIE
04.1 Terapeutické indikácie
Avamys je indikovaný dospelým, mladistvým a deťom (6 rokov a starším).
Avamys je indikovaný na liečbu symptómov alergickej rinitídy.
04.2 Dávkovanie a spôsob podávania
Dávkovanie
Dospelí a mladiství (12 rokov a starší):
Odporúčaná počiatočná dávka sú dve inhalácie (27,5 mcg flutikazónfuroátu na každé vstreknutie) do každej nosovej dierky jedenkrát denne (celková denná dávka 110 mcg).
Akonáhle je dosiahnutá adekvátna kontrola symptómov, dávka znížená na jedno vdýchnutie do nosnej dierky (celková denná dávka 55 mcg) môže byť účinná pre udržiavaciu liečbu.
Dávka sa má titrovať na najnižšiu dávku, pri ktorej sa udržiava účinná kontrola symptómov.
Deti (6 až 11 rokov):
Odporúčaná počiatočná dávka je jeden vdych (27,5 mcg flutikazónfuroátu na každý vdych) do každej nosovej dierky jedenkrát denne (celková denná dávka 55 mcg).
Pacienti, ktorí nereagujú adekvátne na dávku jedného vdýchnutia do každej nosovej dierky jedenkrát denne (celková denná dávka, 55 mcg), môžu použiť dve vdýchnutia do každej nosovej dierky jedenkrát denne (celková denná dávka 110 mcg).
Hneď ako sa dosiahne adekvátna kontrola symptómov, odporúča sa zníženie dávky na jedno vstreknutie do nosovej dierky jedenkrát denne (celková denná dávka 55 mcg).
Pre plný terapeutický úžitok sa odporúča pravidelné a plánované používanie. Nástup terapeutickej aktivity sa pozoruje od 8 hodín po prvom podaní. Na dosiahnutie maximálneho účinku však môže byť potrebná niekoľkodenná liečba. Pacienta treba informovať, že pri pravidelnom používaní sa symptómy zlepšia (pozri časť 5.1) .Dĺžka liečby by mala byť obmedzená na dobu zodpovedajúcu trvaniu expozície alergénom.
Deti do 6 rokov:
Bezpečnosť a účinnosť Avamysu u detí mladších ako 6 rokov nebola stanovená. V súčasnej dobe sú dostupné údaje popísané v častiach 5.1 a 5.2. Nie je však možné poskytnúť žiadne odporúčanie týkajúce sa dávkovania.
Starší pacienti: V tejto populácii nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Zlyhanie obličiek
V tejto populácii nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Pečeňová insuficiencia
U pacientov s ľahkou až stredne ťažkou poruchou funkcie pečene nie je potrebná žiadna úprava dávky. Nie sú k dispozícii žiadne údaje o pacientoch s ťažkým poškodením funkcie pečene. Pri dávkovaní u pacientov s ťažkou hepatálnou insuficienciou je potrebná opatrnosť, pretože u pacientov s hepatálnou insuficienciou môže byť vyššie riziko systémových nežiaducich reakcií spojených s kortikosteroidmi (pozri časti 4.4 a 5.2).
Spôsob podávania
Avamys nosový sprej sa má podávať iba intranazálne
Pred použitím inhalátor poriadne pretrepte. Ak chcete inhalátor aktivovať, držte ho vo zvislej polohe a stlačte tlačidlo uvoľnenia najmenej 6 -krát, kým sa neobjaví jemná hmla. Ak inhalátor ponecháte nekrytý 5 dní alebo ak ho nepoužijete 30 dní alebo viac, aktivačný proces zopakujte (uvoľnite asi 6 obláčiky, kým sa nepozoruje riedka hmla).
Po každom použití vyčistite inhalátor a nasaďte viečko.
04.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
04.4 Špeciálne upozornenia a vhodné opatrenia pri používaní
Systémové účinky kortikosteroidov
Systémové účinky kortikosteroidu podávaného nazálne sa môžu vyskytnúť najmä pri vysokých dávkach podávaných dlhší čas. Tieto účinky sú menej pravdepodobné ako pri perorálnej liečbe kortikosteroidmi a môžu sa líšiť u jednotlivých pacientov a medzi rôznymi kortikosteroidnými prípravkami. Možné systémové účinky môžu zahŕňať Cushingov syndróm, Cushingoidný aspekt, útlm činnosti nadobličiek, spomalenie rastu u detí a mladistvých, katarakta, glaukóm a zriedkavejšie celý rad psychologických alebo behaviorálnych účinkov vrátane psychomotorickej hyperaktivity, porúch spánku, úzkosti, depresie alebo agresivity (najmä u detí) ).
Liečba vyššími ako odporúčanými dávkami nazálnych kortikosteroidov môže mať za následok klinicky významnú adrenálnu supresiu. Ak existujú dôkazy o vyšších ako odporúčaných dávkach, je potrebné vziať do úvahy potrebu dodatočných systémových kortikosteroidov v období stresu alebo elektívnej chirurgie. Dávkovanie 110 mikrogramov flutikazónfuroátu jedenkrát denne nie je spojené s potlačením osi hypotalamus-hypofýza-nadobličky (HPA) u dospelých, dospievajúcich alebo pediatrických jedincov. Dávka intranazálneho flutikazónfuroátu by však mala byť znížená, ako u všetkých intranazálnych kortikosteroidov „Celková systémová záťaž kortikosteroidmi by sa mala vziať do úvahy vždy, keď je predpísaných viac liečebných cyklov s kortikosteroidmi súčasne.
Ak existuje nejaký dôvod domnievať sa, že funkcia nadobličiek je narušená, je potrebná osobitná opatrnosť pri prechode pacientov zo systémovej liečby steroidmi na flutikazónfuroát.
Poruchy zraku: Kortikosteroidy nasálne alebo vdýchnuté môžu viesť k rozvoju glaukómu a / alebo katarakty. Preto je potrebné starostlivé sledovanie u pacientov so zmenou videnia alebo s anamnézou zvýšeného vnútroočného tlaku, glaukómu a / alebo katarakty.
Oneskorenie rastu
U detí, ktoré dostávali nazálne kortikosteroidy v schválených dávkach, bola hlásená spomalenie rastu. U detí liečených flutikazónfuroátom 110 mikrogramov denne počas 1 roka sa pozorovalo zníženie rýchlosti rastu (pozri časti 4.8 a 5.1). Preto by mali byť deti liečené najnižšou možnou účinnou dávkou na adekvátnu kontrolu symptómov. (pozri časť 4.2). Odporúča sa pravidelné sledovanie rastu detí, ktoré sú dlhodobo liečené intranazálnymi kortikosteroidmi. Ak je pozorovaný spomalený rast, terapia sa má znova preskúmať, aby sa podľa možnosti znížila dávka intranazálneho kortikosteroidu na minimálnu dávku, ktorá umožňuje zachovanie účinnej kontroly symptómov rinitídy. Okrem toho by sa mala zvážiť potreba odporučiť pacienta k špecialistovi pediatra (pozri časť 5.1).
Pacienti liečení ritonavirom
Súbežné podávanie ritonaviru sa neodporúča kvôli riziku „zvýšenej systémovej expozície flutikazónfuroátu (pozri časť 4.5).
Pacienti s hepatálnou insuficienciou
Metabolizmus Avamysu je charakterizovaný rozsiahlym first pass efektom, preto je systémová expozícia intranazálnemu flutikazónfuroátu u pacientov so závažným ochorením pečene pravdepodobne zvýšená. To môže viesť k zvýšeniu frekvencie systémových nežiaducich reakcií (pozri časti 4.2 a 5.2) Pri liečbe týchto pacientov sa odporúča opatrnosť.
04.5 Interakcie s inými liekmi a iné formy interakcie
Interakcia s inhibítormi CYP3A4
Flutikazónfuroát sa rýchlo eliminuje extenzívnym metabolizmom prvého prechodu sprostredkovaným cytochrómom P450 3A4.
Na základe údajov získaných s iným glukokortikoidom (flutikazónpropionát), ktorý je metabolizovaný CYP3A4, sa súčasné podávanie s ritonavirom neodporúča, pretože existuje riziko zvýšenej systémovej expozície flutikazónfuroátu.
Pri súbežnom podávaní flutikazónfuroátu a silných inhibítorov CYP3A4 sa odporúča opatrnosť, pretože nemožno vylúčiť zvýšenie systémovej expozície. V štúdii liekových interakcií medzi intranazálnym flutikazónfuroátom a ketokonazolom, silným inhibítorom CYP3A4, bolo pozorovaných viac subjektov s merateľnými koncentráciami flutikazónfuroátu v skupine s ketokonazolom (6 z 20 subjektov) v porovnaní so skupinou s placebom (1 z 20 subjektov). Toto malé zvýšenie expozície neviedlo k štatisticky významnému rozdielu v 24-hodinových hladinách sérového kortizolu medzi týmito dvoma skupinami (pozri časť 4.4).
Údaje o indukcii a inhibícii enzýmov naznačujú, že neexistuje teoretický základ na predpovedanie metabolických interakcií medzi flutikazónfuroátom a metabolizmom iných zlúčenín sprostredkovaným cytochrómom P450 v klinicky relevantných dávkach podávaných intranazálne. Preto neboli vykonané žiadne klinické štúdie na vyhodnotenie interakcií flutikazónfuroátu s inými liekmi.
04.6 Gravidita a laktácia
Tehotenstvo
Nie sú k dispozícii dostatočné údaje o použití flutikazónfuroátu u gravidných žien. V štúdiách na zvieratách preukázalo, že glukokortikoidy spôsobujú malformácie, ako sú rázštep podnebia a spomalenie vnútromaternicového rastu. U ľudí, pretože odporúčané dávky na intranazálne použitie majú za následok minimálnu systémovú expozíciu (pozri Flutikazónfuroát sa má používať počas gravidity iba vtedy, ak prínos pre matku preváži potenciálne riziko pre plod alebo dieťa.
Čas kŕmenia
Nie je známe, či sa intranazálne podávaný flutikazónfuroát vylučuje do ľudského mlieka. Podávanie flutikazónfuroátu dojčiacim ženám by sa malo zvážiť len vtedy, ak je očakávaný prínos pre matku väčší ako akékoľvek možné riziko pre dieťa.
Plodnosť
Nie sú k dispozícii žiadne údaje o fertilite u ľudí.
04.7 Účinky na schopnosť viesť vozidlá a obsluhovať stroje
Avamys nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
04.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu Najčastejšie hlásenými nežiaducimi reakciami počas liečby flutikazónfuroátom sú epistaxa, nazálna ulcerácia a bolesť hlavy. Najzávažnejšími vedľajšími účinkami sú zriedkavé prípady reakcií z precitlivenosti, vrátane anafylaxie (menej ako 1 prípad z 1 000 pacientov).
Tabuľkový zoznam nežiaducich reakcií V štúdiách bezpečnosti a účinnosti bolo viac ako 2 700 pacientov liečených flutikazónfuroátom na sezónnu a celoročnú alergickú nádchu. Detská expozícia flutikazónu v štúdiách bezpečnosti a účinnosti pri sezónnej a celoročnej alergickej rinitíde zahŕňala 243 pacientov 12 až
Na stanovenie frekvencie nežiaducich reakcií boli použité údaje z veľkých klinických štúdií.
Na klasifikáciu frekvencií bol prijatý nasledujúci dohovor:
Veľmi časté ≥ 1/10; Časté ≥1 / 100 -
Popis vybraných nežiaducich reakcií
Epistaxa
* Epistaxa mala spravidla miernu až strednú intenzitu. U dospelých a dospievajúcich bol výskyt epistaxe vyšší pri dlhodobom používaní (viac ako 6 týždňov) ako pri krátkodobom (do 6 týždňov). Po 6 týždňoch).
Systémové efekty
Po nazálnych kortikosteroidoch sa môžu vyskytnúť systémové účinky, najmä ak sú predpisované vo vysokých dávkach po dlhšiu dobu (pozri časť 4.4). U detí, ktoré dostávajú nazálne kortikosteroidy, bola hlásená spomalenie rastu.
Pediatrická populácia
Bezpečnosť u detí mladších ako 6 rokov nebola dostatočne stanovená. Frekvencia, typ a závažnosť nežiaducich reakcií pozorovaných v pediatrickej populácii je podobná ako v dospelej populácii.
Epistaxa
* V pediatrických klinických štúdiách vykonaných až do 12 týždňov bol výskyt epistaxe podobný u pacientov liečených flutikazónfuroátom a pacientov liečených placebom.
Oneskorenie rastu
** V jednoročnej klinickej štúdii hodnotiacej rast u predpubertálnych detí, ktoré dostávali 110 mcg flutikazónfuroátu raz denne, bol v rýchlosti rastu v porovnaní s placebom pozorovaný priemerný rozdiel v liečbe -0,27 cm za rok (pozri Klinická účinnosť a bezpečnosť).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia. "Príloha V.
04,9 Predávkovanie
V štúdii biologickej dostupnosti boli intranazálne dávky až 2 640 mcg denne podávané počas troch dní bez pozorovania nežiaducich systémových reakcií (pozri časť 5.2).
Akútne predávkovanie si pravdepodobne nevyžaduje inú terapiu ako sledovanie pacienta.
05.0 FARMAKOLOGICKÉ VLASTNOSTI
05.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: nazálne prípravky, kortikosteroidy.
ATC kód: R01AD12.
Mechanizmus akcie:
Flutikazónfuroát je syntetický trifluórovaný kortikosteroid, ktorý má veľmi vysokú afinitu k glukokortikoidovému receptoru a má silný protizápalový účinok.
Klinická účinnosť a bezpečnosť:
Sezónna alergická rinitída u dospelých a dospievajúcich:
V porovnaní s placebom nosový sprej flutikazónfuroát 110 mcg raz denne významne zlepšil nosové symptómy (vrátane nádchy, upchatého nosa, kýchania a svrbenia nosa) a očných symptómov (vrátane svrbenia / pálenia, slzenia, dokonca aj intenzívneho slzenia a začervenania očí). 4 štúdie. Účinnosť bola zachovaná počas 24 hodín medzi jedným podaním a ďalším podaním jedenkrát denne.
Nástup terapeutického prospechu bol pozorovaný od 8 hodín po prvom podaní, ďalšie zlepšenia boli pozorované niekoľko dní potom.
Nosový sprej flutikazónfuroát významne zlepšil vnímanie pacientov celkovou reakciou na terapiu a kvalitu života spojenú s ochorením (Rhinoconjunctivie Quality of Life Questionnaire - RQLQ) vo všetkých 4 štúdiách.
Celoročná alergická rinitída u dospelých a dospievajúcich:
Nosový sprej flutikazónfuroát 110 mcg jedenkrát denne významne zlepšil nosové symptómy, ako aj vnímanie celkovej odpovede pacientov na liečbu v porovnaní s placebom v troch štúdiách.
V jednej štúdii nosový sprej flutikazónfuroát 110 mcg raz denne významne zlepšil očné symptómy a kvalitu života súvisiacu s ochorením (RQLQ) v porovnaní s placebom.
Účinnosť bola zachovaná počas 24 hodín medzi dávkami s dávkovaním jedenkrát denne.
V dvojročnej štúdii na vyhodnotenie očnej bezpečnosti flutikazónfuroátu (110 mikrogramov jedenkrát denne intranazálne) boli dospelí a mladiství s celoročnou alergickou rinitídou liečení flutikazónfuroátom (n = 367) alebo placebom (n = 181). Primárne výsledky [čas na zvýšenie zadnej subkapsulárnej nepriehľadnosti (≥ 0,3 oproti východiskovému hodnoteniu v systéme klasifikácie zákalov šošoviek, verzia III (stupeň LOCS III)) a čas na zvýšenie vnútroočného tlaku (vnútroočný tlak; ≥ 7 mmHg v porovnaní s východiskovým stavom) neboli štatisticky významné medzi týmito dvoma skupinami. Zvýšenie zadnej subkapsulárnej opacity (≥ 0,3 oproti východiskovému stavu) bolo častejšie u subjektov liečených flutikazónfuroátom 110 mcg [14 (4%)] v porovnaní s placebom [4 (2%)] a bolo prechodné v povahy pre desať subjektov v skupine s flutikazónfuroátom a dvoch subjektov v skupine s placebom. Zvýšenie vnútroočného tlaku (≥ 7 mmHg oproti východiskovému stavu) bolo častejšie u subjektov liečených 110 mcg flutikazónfuroátu: 7 (2%) pre flutikazónfuroát 110 mcg jedenkrát denne a 1 (a 104, 95% subjektov v oboch liečebných skupinách malo neskoršie hodnoty subkapsulárnej opacity v rozmedzí ± 0,1 východiskových hodnôt pre každé oko I a v 104. týždni ≤ 1% subjektov v oboch liečebných skupinách malo zvýšenie východiskovej subkapsulárnej nepriehľadnosti o ≥ 0,3. V 52. a 104 týždni mala väčšina subjektov (> 95%) hodnoty vnútroočného tlaku v rozmedzí ± 5 mmHg od východiskového stavu. Zvýšenie zadnej subkapsulárnej opacity alebo vnútroočného tlaku nebolo sprevádzané nežiaducimi účinkami katarakty alebo glaukómu.
Pediatrická populácia:
Celoročná a sezónna alergická rinitída u detí:
Pediatrické dávkovanie je založené na vyhodnotení údajov o účinnosti u pediatrickej populácie s alergickou rinitídou.
Pri sezónnej alergickej rinitíde sa ukázal ako účinný nosový sprej flutikazónfuroát 110 µg jedenkrát denne. Neboli však pozorované žiadne významné rozdiely medzi nosovým sprejom flutikazónfuroátu 55 µg jedenkrát denne a placebom v akomkoľvek koncovom bode.
Pri celoročnej alergickej nádche vykazoval nosový sprej flutikazónfuroát 55 mcg raz denne počas 4 týždňov liečby konzistentnejší profil účinnosti ako dávkovanie 110 mcg jedenkrát denne počas 4 týždňov liečby. Post-hoc analýza vykonaná v tej istej 6 a 12-týždňovej štúdii, ako aj 6-týždňovej štúdii bezpečnosti na osi hypotalamus-hypofýza-nadobličky (HPA), podporila účinnosť podávaného nosového spreja flutikazónfuroátu 110 mikrogramov. raz za deň.
6-týždňová štúdia skúmajúca účinok nosovej aerodisperzie flutikazónfuroátu 110 µg jedenkrát denne na funkciu nadobličiek u detí vo veku od 2 do 11 rokov nepreukázala žiadny významný vplyv na profily kortizolu. Sérum počas 24 hodín v porovnaní s placebom.
Jednoročná, randomizovaná, dvojito zaslepená, multicentrická, placebom kontrolovaná klinická štúdia s paralelnými skupinami hodnotila účinok nosovej aerodisperzie flutikazónfuroátu 110 mcg denne na rýchlosť rastu u 474 predpubertálnych detí. (5 až 7,5 roka vek pre ženy a 5 až 8,5 rokov pre mužov) so stadiometrom. Priemerná rýchlosť rastu počas 52-týždňového obdobia liečby bola pomalšia u pacientov liečených flutikazónfuroátom (5,19 cm / rok) oproti placebu (5,46 cm / rok) Priemerný rozdiel v dôsledku liečby bol -0,27 cm za rok [95% CI -0,48 až -0,06].
Celoročná a sezónna alergická nádcha u detí (do 6 rokov):
Štúdie bezpečnosti a účinnosti boli vykonané pre sezónnu aj celoročnú alergickú rinitídu u celkovo 271 pacientov vo veku 2 až 5 rokov, z ktorých 176 bolo vystavených flutikazónu.
Bezpečnosť a účinnosť v tejto vekovej skupine nebola dostatočne stanovená.
05.2 Farmakokinetické vlastnosti
Absorpcia
Flutikazónfuroát podlieha neúplnej absorpcii a rozsiahlemu metabolizmu prvého prechodu pečeňou a črevom, čo má za následok zanedbateľnú systémovú expozíciu. Intranazálne podanie 110 μg jedenkrát denne normálne nemá za následok merateľné plazmatické koncentrácie (pg / ml) Absolútna biologická dostupnosť intranazálne podávaného flutikazónfuroátu je Po podaní 110 mikrogramov by bolo systémovo dostupných 0,50%, ako menej ako 1 mikrogram flutikazónfuroátu (pozri časť 4.9).
Distribúcia
Väzba flutikazónfuroátu na plazmatické bielkoviny je väčšia ako 99%. Flutikazónfuroát je široko distribuovaný s distribučným objemom v rovnovážnom stave v priemere 608 litrov.
Biotransformácia
Flutikazónfuroát sa rýchlo odstraňuje zo systémového obehu (celkový plazmatický klírens 58,7 l / h), predovšetkým pečeňovým metabolizmom na neaktívny metabolit 17β-karboxylových kyselín (GW694301X), enzýmom cytochrómu P450 CYP3A4. Hydrolýzou S-fluórmetylkarbotioátu funkciu za vzniku metabolitu kyseliny 17β-karboxylovej. Vzdelávanie in vivo nevykazovali štiepenie furoátovej časti za vzniku flutikazónu.
Vylúčenie
K eliminácii dochádza primárne stolicou po perorálnom a intravenóznom podaní, čo svedčí o vylučovaní flutikazónfuroátu a jeho metabolitov žlčou. Po intravenóznom podaní polčas polčasu eliminácie trvá v priemere 15,1 hodiny. Vylučovanie močom predstavuje približne 1%, respektíve 2% z perorálnej a intravenóznej dávky.
Pediatrická populácia
Koncentrácia flutikazónfuroátu v krvi nie je u väčšiny pacientov kvantifikovateľná (
Seniori
Farmakokinetické údaje poskytol iba malý počet starších pacientov (≥ 65 rokov, n = 23/872; 2,6%). V porovnaní s mladšou populáciou pacientov nebol vyšší výskyt pacientov s kvantifikovateľnými koncentráciami flutikazónfuroátu u starších osôb.
Zlyhanie obličiek
Po intranazálnom podaní nie je flutikazónfuroát v moči zdravých dobrovoľníkov detegovateľný. Menej ako 1% účinnej látky závislej od dávky sa vylučuje močom, a preto sa neočakáva, že by renálna insuficiencia interferovala s farmakokinetikou flutikazónfuroátu.
Pečeňová insuficiencia
Nie sú k dispozícii žiadne údaje o intranazálnom flutikazóne u pacientov s hepatálnou insuficienciou. Štúdia vykonaná u pacientov so stredne ťažkou hepatálnou insuficienciou liečených jednorazovou perorálnou inhaláciou 400 mikrogramov viedla k zvýšeniu Cmax (42%) a AUC0-∞ (172%) a k miernemu poklesu (v priemere 23%) kortizolu úrovne pacientov v porovnaní so zdravými subjektmi. Na základe tejto štúdie sa neočakáva, že by očakávaná priemerná expozícia 110 mikrogramov intranazálneho flutikazónfuroátu u pacientov so stredne ťažkou poruchou funkcie pečene mala za následok útlm kortizolu. Preto sa neočakáva, že by normálna dávka pre dospelých mala za následok útlm kortizolu. Výsledkom je klinicky relevantný účinok u pacientov so stredne ťažkou hepatálnou insuficienciou. Nie sú k dispozícii žiadne údaje o pacientoch s ťažkou hepatálnou insuficienciou. Expozícia flutikazónfuroátu v tejto populácii pacientov bude pravdepodobne ešte zvýšená.
05.3 Predklinické údaje o bezpečnosti
Vo všeobecných toxikologických štúdiách boli výsledky podobné tým, ktoré sa pozorovali pri iných kortikosteroidoch, a sú spojené s "nadmernou farmakologickou aktivitou. Tieto zistenia pravdepodobne nie sú relevantné pre ľudí, pretože odporúčané nazálne dávky majú za následok" minimálnu systémovú expozíciu. Pri bežných testoch genotoxicity neboli pozorované žiadne genotoxické účinky flutikazónu. V dvojročných inhalačných štúdiách na myšiach a potkanoch navyše nedošlo k zvýšeniu výskytu nádorov spojených s liečbou.
06.0 FARMACEUTICKÉ INFORMÁCIE
06.1 Pomocné látky
Bezvodá glukóza
Dispergovateľná celulóza
Polysorbát 80
Benzalkóniumchlorid
Edetát dvojsodný
Vyčistená voda
06.2 Nekompatibilita
Nie je to relevantné.
06.3 Obdobie platnosti
3 roky.
Platnosť: 2 mesiace od prvej aktivácie.
06.4 Špeciálne opatrenia na uchovávanie
Neuchovávajte v chladničke a mrazničke.
Skladujte vo zvislej polohe. Vždy majte nasadený uzáver.
06.5 Charakter vnútorného obalu a obsahu balenia
14,2 ml vo fľaši z jantárového skla (sklo) typu I alebo typu III vybavenej dávkovacou pumpou.
Liek je dostupný v troch baleniach: fľaša s 30, 60 alebo 120 inhaláciami.
Na trh nemusia byť uvedené všetky veľkosti balenia.
06.6 Návod na použitie a zaobchádzanie
Žiadne špeciálne pokyny na likvidáciu.
07.0 DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Glaxo Group Ltd
980 Great West Road, Brentford, Middlesex, TW8 9GS
UK
08.0 REGISTRAČNÉ ČÍSLO
EU/1/07/434/001
038343012
EU/1/07/434/002
038343024
EU/1/07/434/003
038343036
09.0 DÁTUM PRVEJ REGISTRÁCIE ALEBO OBNOVENIA REGISTRÁCIE
Dátum prvej registrácie: 11. januára 2008
Dátum posledného obnovenia: 11. januára 2013
10.0 DÁTUM REVÍZIE TEXTU
Apríl 2014